Degenerazione Maculare umida e Edema Maculare Diabetico: un nuovo farmaco per combattere queste condizioni
E’ delle settimane scorse l’approvazione da parte della FDA di Vabysmo™ (Faricimab- SVOA) prodotto da Genentech (membro gruppo Roche), di un nuovo farmaco per il trattamento della degenerazione maculare umida (AMD) e dell’edema maculare diabetico (DME). L’AMD umida, o neovascolare, è una forma di degenerazione maculare che colpisce la parte della retina (la macula) che fornisce una visione nitida e centrale necessaria per attività come la lettura, ed è una delle principali cause di cecità per le persone di età superiore ai 55 anni. Questa condizione della malattia, se non trattata, può causare una rapida e grave perdita della vista.
L’AMD umida è causata dalla crescita di vasi sanguigni anormali, nella macula. Questi vasi trasudano sostanze ematiche e causano tessuto cicatriziale che distrugge la retina centrale.
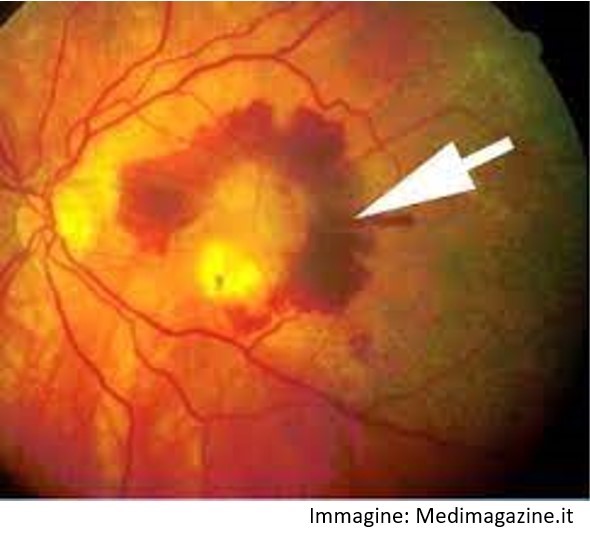
L’edema maculare diabetico (DME) rappresenta la principale causa di disturbi visivi nei pazienti diabetici ed è una condizione che può insorgere in qualsiasi stadio della malattia. Si può indicare che i pazienti che soffrono di diabete da più di 20 anni hanno la probabilità 5 volte maggiore di sviluppare il DME rispetto a coloro che hanno il diabete da meno di 10 anni. Il DME si verifica quando i vasi sanguigni danneggiati nella retina penetrano e causano gonfiore nella macula, l’area centrale della retina responsabile della visione nitida necessaria per leggere e guidare.
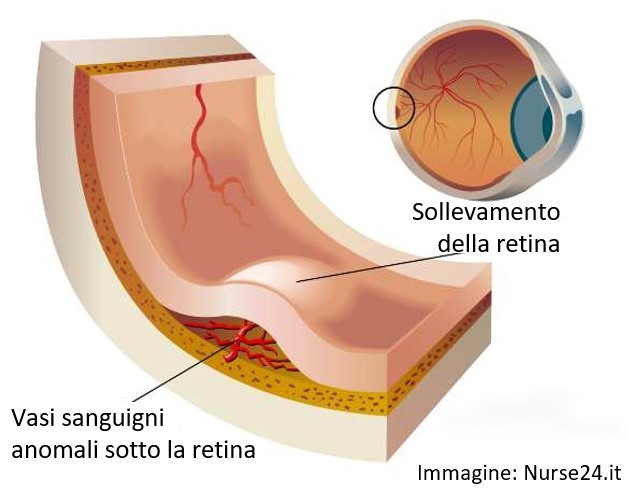
Il nuovo farmaco, somministrato tramite iniezioni intravitreali, prende di mira e inibisce le due vie di sviluppo delle patologie viste sopra, essendo progettato per bloccare i percorsi che coinvolgono l’angiopoietina-2 (Ang-2) e il fattore di crescita dell’endotelio vascolare-A (VEGF-A). Si considera che Ang-2 e VEGF-A contribuiscano alla perdita della vista deteriorando i vasi sanguigni, che possono causare la formazione di nuovi vasi che danno origine a degli essudati e aumento dell’infiammazione. Mentre ulteriori ricerche continuano, in studi preclinici è stato dimostrato che l’inibizione di entrambi i percorsi ha benefici potenzialmente complementari, stabilizzando i vasi e riducendo così la loro permeabilità e l’infiammazione degli stessi.
L’approvazione da parte dell’FDA si basa sui risultati positivi di quattro studi multicentrici internazionali di Fase III, due per l’AMD umida (TENAYA e LUCERNE) e due per l’DME (YOSEMITE e RHINE). Evidenziato nei comunicati dell’azienda Genentech, gli studi hanno costantemente dimostrato che i pazienti trattati con Vabysmo™ (Faricimab) somministrato a intervalli fino a quattro mesi hanno ottenuto miglioramenti della vista non inferiori rispetto a Aflibercept, somministrato ogni due mesi nel primo anno. Il farmaco è stato generalmente ben tollerato in tutti e quattro gli studi, con un profilo rischio-beneficio favorevole. La reazione avversa più comune (≥5%) riportata nei pazienti trattati con il farmaco è stata l’emorragia congiuntivale (7%).
Due articoli scientifici e un editoriale su questi risultati di un anno sono stati recentemente pubblicati sulla rivista scientifica The Lancet.
Con Vabysmo™ (Faricimab), le persone con AMD umida ricevono inizialmente quattro trattamenti mensili. Sulla base dei risultati anatomici e visivi, possono ricevere trattamenti successivi ogni due, tre o quattro mesi. Le persone con DME inizialmente ricevono quattro trattamenti mensili. Successivamente il loro trattamento può essere esteso o ridotto anche in questo caso in base ai risultati anatomici e visivi, con un intervallo da uno a quattro mesi tra le dosi. Un secondo regime di trattamento approvato per il DME prevede sei dosi di carico mensili, seguite da un trattamento ogni due mesi. Alcune persone con AMD umida e DME in caso sia necessario, possono essere trattate mensilmente, sebbene non sia stata dimostrata un’ulteriore efficacia nella maggior parte dei pazienti trattati.
Genentech ha inoltre in corso due studi di estensione (AVONELLE-X per l’AMD umida) e (RHONE-X per la DME) per valutare sicurezza e tollerabilità a lungo termine.
Il farmaco sarà disponibile negli Stati Uniti nelle prossime settimane. Mentre in Europa l’Agenzia europea dei medicinali EMA, sta inoltre valutando la domanda di autorizzazione all’immissione in commercio recentemente presentata dall’azienda.
Come con ogni nuovo farmaco, se tutto continuerà a procedere positivamente. sia per AMD umida che per DME, potranno ridursi le problematiche legate alle somministrazioni frequenti della terapia e aumentarne l’efficacia.
Vai alla pagina News
Vai alla pagina Notizie Scientifiche